Cuando las células copian el ADN para producir transcripciones de ARN, incluyen solo algunos trozos de material genético conocidos como exones y tiran el resto a la basura. El producto que resulta es una molécula madura de ARN, que luego podría usarse como plantilla para construir una proteína.
Una de las características de la expresión génica es que, a través de un proceso conocido como 'alternative splicing’ en inglés, una célula puede seleccionar diferentes combinaciones de exones para hacer diferentes transcripciones de ARN. Al igual que los productores de cine, que crean la versión estándar de la película y la versión del director, la inclusión o exclusión de un solo exón puede resultar en la producción de proteínas con diferentes funciones.
Los seres vivos utilizan el splicing para permitir funciones complejas. Diferentes tipos de células en diferentes tipos de tejidos producen diferentes transcripciones de ARN a partir del mismo gen. Comprender cómo funciona este proceso proporciona nuevas pistas sobre el desarrollo humano, la salud y la enfermedad y allana el camino para el desarrollo de nuevos diagnósticos y terapias.
En los últimos años, se ha descubierto un tipo de secuencia de ADN que codifica proteínas - los microexones. Con solo una longitud que oscila entre los tres y los 27 nucleótidos, los microexones son mucho más cortos que otros exones, cuyo tamaño promedio es de alrededor de 150 nucleótidos. La existencia de microexones en muchas especies diferentes, desde moscas hasta mamíferos, sugiere que tienen una función importante porque han sido conservados por la selección natural durante cientos de millones de años.
En los seres humanos, la mayoría de los microexones se encuentran exclusivamente en las células neuronales, donde los pequeños fragmentos ejercen un gran poder. Por ejemplo, estudios recientes muestran que son cruciales para el desarrollo de fotorreceptores, un tipo de neurona en la retina. También se ha demostrado que las alteraciones en la actividad de los microexones son comunes en los cerebros de personas con autismo, lo que sugiere que los pequeños fragmentos de genes juegan un papel importante en las características clínicas de esta condición.
"Un microexón es un fragmento corto de ADN que codifica unos pocos aminoácidos, los componentes básicos de las proteínas. Aunque no conocemos los mecanismos de acción exactos, la inclusión o exclusión de solo un puñado de estos aminoácidos durante el splicing esculpe las superficies de las proteínas de una manera altamente precisa. Por lo tanto, el splicing de los microexones puede verse como una forma de realizar microcirugía en las proteínas del sistema nervioso, modificando la forma en que interactúan con otras moléculas en las sinapsis altamente especializadas de las neuronas", explica el profesor de investigación ICREA Manuel Irimia, investigador del Centro de Regulación Genómica (CRG) que explora el papel funcional de los microexones.
Conjuntamente con el profesor de investigación ICREA Juan Valcárcel, también en el CRG, el Dr. Irimia ha descubierto que los microexones también se encuentran en otro tipo de célula que lleva a cabo funciones altamente especializadas dentro de tejidos y órganos complejos: las células endocrinas en el páncreas. El splicing de microexones ocurre con frecuencia en los islotes pancreáticos, tejidos que albergan células beta que producen la hormona insulina. Los hallazgos se han publicado en la revista Nature Metabolism.
El descubrimiento se llevó a cabo mientras el equipo estudiaba el papel del splicing en la biología de los islotes pancreáticos y el mantenimiento de los niveles de glucosa en la sangre. Estudiaron datos de secuencias de ARN de diferentes tejidos humanos y de roedores, buscando diferencias en el splicing de exones en los islotes pancreáticos en comparación con otros tejidos.
La mitad de los exones específicamente enriquecidos en los islotes pancreáticos eran microexones, casi todos los cuales también existen en las células neuronales. El hallazgo está en línea con la idea de que las células de los islotes pancreáticos han evolucionado tomando prestados mecanismos reguladores de las células neuronales.
De los más de cien microexones de islotes pancreáticos encontrados, la mayoría se localizaron en genes críticos para la secreción de insulina o relacionados con el riesgo de padecer diabetes tipo 2. La inclusión de los microexones está controlada por SRRM3, una proteína que funciona uniéndose a las moléculas de ARN y que está codificada por elgen SRRM3.
Los autores del estudio mostraron que los niveles altos de glucosa en la sangre indujeron tanto la expresión de SRRM3 como la inclusión de microexones, lo que sugiere la posibilidad de que la regulación del splicing de microexones podría desempeñar un papel en el mantenimiento de los niveles de glucosa en la sangre.
Para comprender mejor el impacto de los microexones de los islotes, llevaron a cabo varios experimentos funcionales utilizando células beta humanas cultivadas en el laboratorio, así como experimentos in vivo y ex vivo con ratones que carecen del gen SRRM3.
Descubrieron que el agotamiento de SRRM3 o la represión de microexones individuales alteran la secreción de la insulina en las células beta. En ratones, las alteraciones en el splicing de los microexones cambian la forma de los islotes pancreáticos, lo que finalmente afecta a la liberación de insulina.
El equipo científico también trabajó conjuntamente con el grupo de Jorge Ferrer, investigador del CIBERDEM en el CRG, para estudiar datos genéticos y de transcripción de ARN procedentes de individuos con y sin diabetes, y explorar así posibles vínculos entre los microexones y los trastornos metabólicos humanos. Encontraron que las variantes genéticas que afectan la inclusión de microexones están relacionadas con variaciones en los niveles de glucosa en sangre en ayunas y también con el riesgo de padecer diabetes tipo 2. También encontraron que los pacientes con diabetes tipo 2 tienen niveles más bajos de microexones en sus islotes pancreáticos.
Los hallazgos allanan el camino para explorar nuevas estrategias terapéuticas para tratar la diabetes mediante la modulación del splicing. "Mostramos que los microexones de los islotes juegan un papel importante en la función de los islotes y el mantenimiento de la glucosa, lo que podría contribuir a la predisposición a la diabetes tipo 2. Por esta razón, los microexones pueden constituir dianas terapéuticas novedosas para tratar las células beta disfuncionales en la diabetes tipo 2", explica Jonas Juan Mateu, primer autor del estudio e investigador postdoctoral en el CRG.
"Ya existe una amplia gama de moduladores de splicing, disponible para tratar una variedad de enfermedades humanas. Cuando comencé a estudiar el splicing en islotes pancreáticos hace ocho años, quería averiguar si los moduladores de splicing existentes podrían reutilizarse para la diabetes. Creo que estamos un paso más cerca de eso", añade el Dr. Juan Mateu.
Aunque el trabajo muestra la importancia de los microexones en los islotes pancreáticos, la ciencia sigue sin determinar su impacto preciso durante el desarrollo del tejido. Falta información de los mecanismos que explican cómo cada microexón individual altera la función de la proteína y afecta las funciones claves en las células de los islotes. Comprender esto ayudará conocer el papel fisiológico exacto en la diabetes y otras enfermedades metabólicas relacionadas con los islotes pancreáticos.
El estudio se suma a una creciente evidencia que muestra que los microexones desempeñan un papel crucial en el desarrollo humano, la salud y la enfermedad. "Menos de 10 años después de que informáramos por primera vez sobre su existencia, estamos viendo cómo los microexones son elementos clave que modifican la forma en que las proteínas interactúan entre sí en células con funciones que requieren un alto grado de especialización, como la liberación de neurotransmisores o insulina y la transducción de luz", explica el Dr. Irimia.
"En consecuencia, esperamos que las mutaciones en los microexones nos conduzcan a enfermedades cuyas causas genéticas aún no hemos entendido. Estamos empezando a buscar estas mutaciones en pacientes con trastornos del neurodesarrollo y metabólicos, así como retinopatías, para luego idear posibles intervenciones para tratarlas", concluye.
Los hallazgos fueron realizados por un equipo liderado por los profesores de investigación ICREA Manuel Irimia y Juan Valcárcel, jefes de grupo en los programas de Biología de Sistemas y Sintética, y Biología Genómica, respectivamente, en el CRG. Entre los colaboradores se incluye Jorge Ferrer, coordinador del programa de Biología Computacional y Genómica de la Salud, y jefe de grupo en el CRG y el CIBERDEM.
Referencia del artículo:
Juan-Mateu, J., Bajew, S., Miret-Cuesta, M. et al. Pancreatic microexons regulate islet function and glucose homeostasis. Nat Metab (2023). https://doi.org/10.1038/s42255-022-00734-2
La investigación ha contado con el apoyo de una ayuda de Investigación en Salud de la Fundación "la Caixa", el Consejo Europeo de Investigación (ERC), las becas posdoctorales Marie Sklodowska-Curie de la Unión Europea, la Fundación Europea para el Estudio de la Diabetes (EFSD) y el Programa Europeo de Investigación en Diabetes de Lilly.
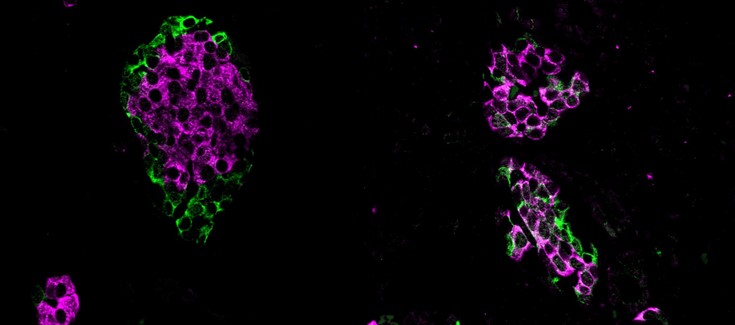
*Imagen
La imagen muestra islotes pancreáticos en ratones, tejidos especializados que albergan células beta. A la izquierda, se muestra un islote pancreático sano con su morfología típica con células alfa en la periferia y células beta en el núcleo del islote. A la derecha, los ratones con una mutación en Srrm3, que elimina la capacidad de las células para regular la inclusión de microexones, dan como resultado islotes con morfología e identidad celular alteradas. Esta y otras alteraciones funcionales finalmente impactan en la liberación de insulina y la capacidad de controlar los niveles de glucosa en sangre.